分享一篇发表在Nature chemical biology上的文章,文章的题目是“µMap proximity labeling in living cells reveals stress granule disassembly mechanisms”,作者是来自普林斯顿大学杰出化学教授David W. C. MacMillan。其研究领域主要包含有机催化、级联催化、协同催化、光还原催化和金属光还原催化及其在天然产物和药物的全合成中的应用。利用光催化研究复杂的生物环境。
细胞过程通过多种结构的隔室化进行调控,其中包括通过液-液相分离形成的无膜细胞器。这样的凝聚体主要由核酸和蛋白质组成,在调节基因表达、应对压力和信号传导网络中发挥关键作用。应激颗粒(SGs)作为其中一种相分离的凝聚体,受到广泛关注,因为它们在细胞应激时瞬时形成,并在去除应激因子后以动态方式解体。现有证据表明,SGs不仅在应激条件下暂时储存和保护某些mRNA和蛋白质,还会对RNA加工、细胞器功能和整体细胞命运产生深远影响。此外,凝聚体的组织失调与多种神经退行性疾病相关。因此,理解SG的动态变化可以揭示细胞组织的基本规律,并促进新的治疗方法的发展。SG解体被认为涉及多种后转录修饰,包括泛素化。泛素化在应激诱导的SG解体中起重要作用。SG的组成和动态变化也被发现与特定的应激状况高度相关。尽管研究这些瞬时凝聚体的重要性显而易见,但其研究仍面临重大挑战。由于缺乏膜结构且形状和大小变化多端,传统的分离方法难以有效地分离和研究这些液滴。此外,凝聚体的组成在形成和解体过程中高度动态,完全表征这一变化的蛋白质组需要高时空分辨率的技术。在这种背景下,邻近标记法(µMap)被提出,作为一种强大且通用的方法来研究瞬态蛋白质-蛋白质互动。本研究扩展了µMap的作用:结合HaloTag,将细胞渗透性的Ir催化剂安装到感兴趣的细胞内蛋白上,研究影响SG解体的机制。为了建立HaloMap平台以进行颗粒蛋白组分析,作者首先在HEK293细胞中稳定表达HaloTag–G3BP1融合蛋白。与此同时,细胞与可透膜的µMap Ir催化剂孵育。µMap Ir催化剂带有一种聚乙二醇(PEG)4-己基氯配体,可与 HaloTag发生共价烷基化反应(图1a)。然后引入生物素-双吖丙啶探针进行后续蓝光光激活以标记邻近蛋白(图1b)。为了诱导颗粒形成,作者应用了亚砷酸钠处理应激(AS;500µM NaAsO2)。通过免疫荧光技术,作者验证了在应用AS时,生物素化信号与HaloTag–G3BP1的细胞质颗粒结构的共定位,表明这些相分离结构的高分辨率邻近标记(图1c)。接下来,作者利用label-free定量蛋白组学检测SG蛋白组成变化。作者识别出371个假定的G3BP1相互作用者作为应激诱导颗粒候选者(图1d)。这些相互作用者与先前报道的 SG 蛋白具有很大的重叠性,而最高度富集的候选者(NUFIP2,UBAP2L,CAPRIN1等)一贯被认为是颗粒的核心结构组分(图1d)。这些结果有效验证了方法的准确性,并证实了之前关于AS诱导颗粒组成的研究。同时,作者也鉴定到之前并未报道的蛋白。作者通过免疫荧光技术确认这些相互作用蛋白在AS下定位于SGs(图1e)。G3BP1及若干相关SG蛋白也被认为在正常条件下预先相互作用。作者假设HaloMap也可以分析这些应激前相互作用。作者比较了在没有应激下HaloTag–G3BP1的相互作用组,并识别出14个高度富集的蛋白,包括USP10,G3BP2,FXR2和YTHDF3等(图1f)。这些相互作用蛋白被推测与G3BP1形成“预置”复合物,可能在SGs的快速形成中起作用。总之,这些发现表明细胞内HaloMap可以有效且准确地捕获不应激或应激诱导的G3BP1/SG相互作用组。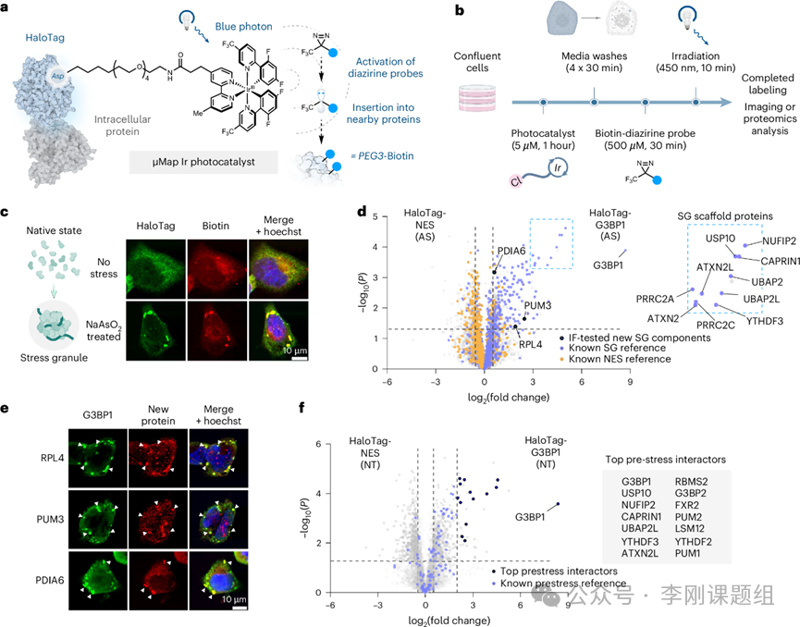 在建立了HaloMap标记平台后,作者接下来试图分析SG解聚过程中发生的蛋白组学变化,以捕捉可能的关键调节因子。SG在新鲜培养基中约2小时后完全解聚(图2a)。基于这些动态学,作者在去除AS后的30分钟(D30)、60分钟(D60)和120分钟(D120)进行HaloMap标记,以代表解聚过程的早期、中期和晚期(图2b)。从每个时间点的HaloTag-G3BP1与HaloTag-NES标记比较中,鉴定到698个SG相互作用蛋白水平变化。随着颗粒的解聚,大约70%的颗粒相互作用蛋白的富集随着恢复而降低(图2c)。然而,作者对一组在恢复期间呈现出增加关联的蛋白质(n=203)的出现感到兴趣,因为这些可能是颗粒解聚的调控蛋白。GO分析显示出明显富集的蛋白质,主要是正向调节或启动翻译的蛋白质,即随着细胞从应激中恢复,mRNA从颗粒的释放和翻译。此外,多个与泛素化和蛋白质质量控制途径相关的蛋白质也显示出富集(图2c)。接下来,通过免疫荧光,作者观察到在应激处理后,泛素信号与G3BP1/颗粒的强重叠,这表明这些凝聚物含有多泛素化的蛋白。此外,作者确认在应激和早期恢复时(应激后30分钟)整体多泛素水平的上调(图2e)。为了进一步了解泛素化对颗粒动力学的影响,作者接下来测试了在存在TAK-243(MLN7243),一种强效的泛素激活酶(UAE)抑制剂的情况下,凝聚物的形成和解聚(图2f)。作者在不同时间段抑制泛素化(1)在颗粒形成和解聚的整个周期(TAK-243-1),(2)在颗粒形成期间(TAK-243-2),以及(3)仅在解聚期间(TAK-243-3;图2g)。这些比较结果显示,在任何一个时期(组1,2或3)抑制泛素化对颗粒形成的影响较小。然而,当在颗粒形成期间抑制泛素化时(TAK-243-1和TAK-243-2)观察到了显著延迟的颗粒解聚,而在仅在解聚期间施用TAK-243时(TAK-243-3)则观察到了轻微的延迟(图2h)。总的来说,这些结果强烈表明泛素化对颗粒解聚至关重要。 图2 HaloMap分析泛素化对于SG解聚是关键的修饰。3.相互作用组图谱 (+/−)TAK-243 确定候选调节因子作者因此在HaloTag–G3BP1稳定细胞系上对比了有无TAK-243处理下的细胞在应激前及整个解聚过程中的情况(图3a)。鉴定到由TAK-243抑制多聚泛素化所触发的颗粒蛋白组差异。作者聚焦于与泛素通路相关的差异富集蛋白,首先搜索了E3连接酶,识别出了在(+)TAK-243细胞中于应激后富集的几种候选蛋白(图3b、c)。其中包括E3连接酶,识别泛素翻译后修饰(PTMs)的蛋白以及作为颗粒解聚的蛋白。作者还识别出几种与自噬相关的泛素受体,包括SQSTM1、HDAC6和TOLLIP,所有这些蛋白都已被证明能够识别聚泛素化底物以进行自噬靶向和降解(图3d、e)。
在建立了HaloMap标记平台后,作者接下来试图分析SG解聚过程中发生的蛋白组学变化,以捕捉可能的关键调节因子。SG在新鲜培养基中约2小时后完全解聚(图2a)。基于这些动态学,作者在去除AS后的30分钟(D30)、60分钟(D60)和120分钟(D120)进行HaloMap标记,以代表解聚过程的早期、中期和晚期(图2b)。从每个时间点的HaloTag-G3BP1与HaloTag-NES标记比较中,鉴定到698个SG相互作用蛋白水平变化。随着颗粒的解聚,大约70%的颗粒相互作用蛋白的富集随着恢复而降低(图2c)。然而,作者对一组在恢复期间呈现出增加关联的蛋白质(n=203)的出现感到兴趣,因为这些可能是颗粒解聚的调控蛋白。GO分析显示出明显富集的蛋白质,主要是正向调节或启动翻译的蛋白质,即随着细胞从应激中恢复,mRNA从颗粒的释放和翻译。此外,多个与泛素化和蛋白质质量控制途径相关的蛋白质也显示出富集(图2c)。接下来,通过免疫荧光,作者观察到在应激处理后,泛素信号与G3BP1/颗粒的强重叠,这表明这些凝聚物含有多泛素化的蛋白。此外,作者确认在应激和早期恢复时(应激后30分钟)整体多泛素水平的上调(图2e)。为了进一步了解泛素化对颗粒动力学的影响,作者接下来测试了在存在TAK-243(MLN7243),一种强效的泛素激活酶(UAE)抑制剂的情况下,凝聚物的形成和解聚(图2f)。作者在不同时间段抑制泛素化(1)在颗粒形成和解聚的整个周期(TAK-243-1),(2)在颗粒形成期间(TAK-243-2),以及(3)仅在解聚期间(TAK-243-3;图2g)。这些比较结果显示,在任何一个时期(组1,2或3)抑制泛素化对颗粒形成的影响较小。然而,当在颗粒形成期间抑制泛素化时(TAK-243-1和TAK-243-2)观察到了显著延迟的颗粒解聚,而在仅在解聚期间施用TAK-243时(TAK-243-3)则观察到了轻微的延迟(图2h)。总的来说,这些结果强烈表明泛素化对颗粒解聚至关重要。 图2 HaloMap分析泛素化对于SG解聚是关键的修饰。3.相互作用组图谱 (+/−)TAK-243 确定候选调节因子作者因此在HaloTag–G3BP1稳定细胞系上对比了有无TAK-243处理下的细胞在应激前及整个解聚过程中的情况(图3a)。鉴定到由TAK-243抑制多聚泛素化所触发的颗粒蛋白组差异。作者聚焦于与泛素通路相关的差异富集蛋白,首先搜索了E3连接酶,识别出了在(+)TAK-243细胞中于应激后富集的几种候选蛋白(图3b、c)。其中包括E3连接酶,识别泛素翻译后修饰(PTMs)的蛋白以及作为颗粒解聚的蛋白。作者还识别出几种与自噬相关的泛素受体,包括SQSTM1、HDAC6和TOLLIP,所有这些蛋白都已被证明能够识别聚泛素化底物以进行自噬靶向和降解(图3d、e)。 图3 颗粒蛋白组在应激前到晚期解体状态中的变化,包括有(+)和没有(-)TAK-243的情况。作者在HaloMap实验中发现HECT E3连接酶的富集。为了研究HECT E3连接酶是否在SG的解体中起作用,作者在刺激和恢复期间用HECT连接酶特异性抑制剂heclin处理细胞。在120分钟的恢复期(D120),heclin处理的样本中仍然残留大量的颗粒(图4a,b)。作者接下来探索了特定的HECT E3连接酶或其相关结合蛋白是否调节SG(应激颗粒)的解体。为此,作者对在HaloMap中识别的每个候选蛋白进行了siRNA敲低实验,包括所有四种连接酶(WWP2、ITCH、NEDD4和NEDD4L)以及两个结合蛋白(NDFIP1和NDFIP2)。单独敲低ITCH、NEDD4L和NDFIP1导致SG解体的明显延迟。鉴于这些连接酶之前未与颗粒相关联,作者通过针对颗粒标记物G3BP1的免疫荧光确认了它们的亚细胞定位,观察到它们在NaAsO2处理后被招募到SG中(图4e)。过表达或siRNA敲低ITCH或NEDD4L均未影响初始的颗粒形成,这与作者对TAK-243和heclin抑制多聚泛素化的结果一致(图4e)。综合这些数据,表明特定的HECT E3连接酶,包括ITCH、NEDD4L及其相关结合蛋白NDFIP1,直接在泛素介导的SG解体中发挥调节作用。作者接下来希望确定HECT依赖性泛素化在颗粒中的具体机制及其在控制解体速率中的作用。作者最初使用TUBE方法对全泛素底物变化分析,比较在有(+)和无(−)heclin的情况下形成颗粒的细胞(图4f)。GO分析显示受到heclin影响的泛素组在囊泡介导的运输、K63多聚泛素链调节和自噬方面表现出功能富集。接下来,作者重复了这个泛素组分析实验,但使用K63特异性TUBE富集(图4f)。在此过程中,作者识别到181个通常在应激下K63特异性泛素化增加但在heclin处理后显著降低修饰水平的蛋白,其中31个已知是SG成分。免疫荧光分析显示heclin处理期间颗粒区域内K63特异性泛素信号的重叠减少(图4g)。这些数据表明HECT E3连接酶通过调控特定颗粒蛋白上的K63多聚泛素化来调节颗粒的解体。 后续,作者鉴定到泛素受体TOLLIP蛋白,并通过自噬途径介导颗粒动态。在本研究中,作者应用基于HaloTag的平台(μMap)进行邻近标记,以表征活细胞中的应激颗粒动态变化。揭示了若干与泛素相关的调节因子,包括HECT(与E6AP C末端同源)E3连接酶ITCH和NEDD4L,以及泛素受体TOLLIP,作为颗粒解体的关键介导因子。此外,作者还识别出一个促进颗粒清除的自噬相关通路。总的来说,这项工作建立了一种常规的光催化的邻近标记方法,用于揭示细胞内蛋白质相互作用组,并发现了调节应激颗粒动态的先前未探讨的机制。原文链接:https://www.nature.com/articles/s41589-024-01721-2原文引用:doi: 10.1038/s41589-024-01721-2
图3 颗粒蛋白组在应激前到晚期解体状态中的变化,包括有(+)和没有(-)TAK-243的情况。作者在HaloMap实验中发现HECT E3连接酶的富集。为了研究HECT E3连接酶是否在SG的解体中起作用,作者在刺激和恢复期间用HECT连接酶特异性抑制剂heclin处理细胞。在120分钟的恢复期(D120),heclin处理的样本中仍然残留大量的颗粒(图4a,b)。作者接下来探索了特定的HECT E3连接酶或其相关结合蛋白是否调节SG(应激颗粒)的解体。为此,作者对在HaloMap中识别的每个候选蛋白进行了siRNA敲低实验,包括所有四种连接酶(WWP2、ITCH、NEDD4和NEDD4L)以及两个结合蛋白(NDFIP1和NDFIP2)。单独敲低ITCH、NEDD4L和NDFIP1导致SG解体的明显延迟。鉴于这些连接酶之前未与颗粒相关联,作者通过针对颗粒标记物G3BP1的免疫荧光确认了它们的亚细胞定位,观察到它们在NaAsO2处理后被招募到SG中(图4e)。过表达或siRNA敲低ITCH或NEDD4L均未影响初始的颗粒形成,这与作者对TAK-243和heclin抑制多聚泛素化的结果一致(图4e)。综合这些数据,表明特定的HECT E3连接酶,包括ITCH、NEDD4L及其相关结合蛋白NDFIP1,直接在泛素介导的SG解体中发挥调节作用。作者接下来希望确定HECT依赖性泛素化在颗粒中的具体机制及其在控制解体速率中的作用。作者最初使用TUBE方法对全泛素底物变化分析,比较在有(+)和无(−)heclin的情况下形成颗粒的细胞(图4f)。GO分析显示受到heclin影响的泛素组在囊泡介导的运输、K63多聚泛素链调节和自噬方面表现出功能富集。接下来,作者重复了这个泛素组分析实验,但使用K63特异性TUBE富集(图4f)。在此过程中,作者识别到181个通常在应激下K63特异性泛素化增加但在heclin处理后显著降低修饰水平的蛋白,其中31个已知是SG成分。免疫荧光分析显示heclin处理期间颗粒区域内K63特异性泛素信号的重叠减少(图4g)。这些数据表明HECT E3连接酶通过调控特定颗粒蛋白上的K63多聚泛素化来调节颗粒的解体。 后续,作者鉴定到泛素受体TOLLIP蛋白,并通过自噬途径介导颗粒动态。在本研究中,作者应用基于HaloTag的平台(μMap)进行邻近标记,以表征活细胞中的应激颗粒动态变化。揭示了若干与泛素相关的调节因子,包括HECT(与E6AP C末端同源)E3连接酶ITCH和NEDD4L,以及泛素受体TOLLIP,作为颗粒解体的关键介导因子。此外,作者还识别出一个促进颗粒清除的自噬相关通路。总的来说,这项工作建立了一种常规的光催化的邻近标记方法,用于揭示细胞内蛋白质相互作用组,并发现了调节应激颗粒动态的先前未探讨的机制。原文链接:https://www.nature.com/articles/s41589-024-01721-2原文引用:doi: 10.1038/s41589-024-01721-2



 图3 颗粒蛋白组在应激前到晚期解体状态中的变化,包括有(+)和没有(-)TAK-243的情况。
图3 颗粒蛋白组在应激前到晚期解体状态中的变化,包括有(+)和没有(-)TAK-243的情况。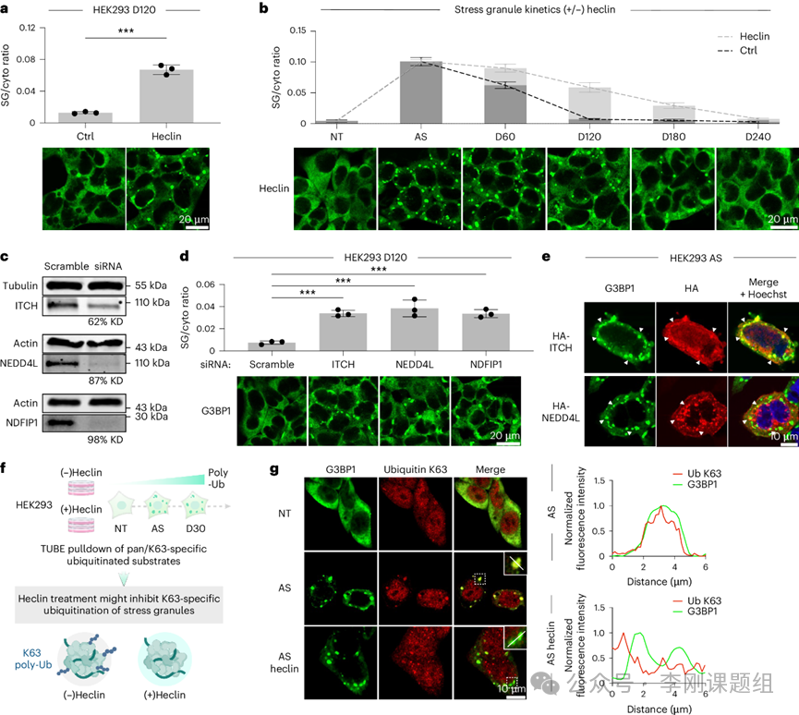


目前评论:0